一、碳二亚胺类缩合剂法
这类方法所使用的缩合剂主要有二环己基碳二亚胺(DCC)、二异丙基碳二亚胺(DIC)和1-(3-二甲胺基丙基)-3-乙基碳二亚胺(EDC)三种化学试剂。
由于这种反应生成的中间体的不稳定性,会使得其进行重新排列生成更稳定的脲副产物(Path b),所以我们需要向其中添加酰化催化剂或活化剂以保证其转化为相应的活性酯或活性酰胺。
在这三种缩合剂中,DCC和DIC相对EDC而言价格更便宜。一般DCC和DMAP合用,但反应的另一产物二环己基脲在一般的有机溶剂中溶解度很小但又都有一些微溶,所以需要蒸掉反应溶剂后加入乙醚,滤掉大部分的二环己基脲后再进一步处理。而DIC由于其产生的二异丙基脲在有一般的有机溶剂中溶解度较好,因此一般在组合化学的固相合成中用的较多。此外,目前在药物化学中用的最多的是EDC,一般EDC与HOBt,合用其一个主要的特点就是其反应后生成的脲是水溶性的,容易被洗掉。
二、混合酸酐法
1、氯甲酸酯法:主要通过羧酸与氯甲酸乙酯或异丁酯反应生成混合酸酐,再与胺反应得到相应的酰胺。这一反应如果酸的a-位位阻大或者连有吸电子基团,有时会停留在混合酸酐这一步,但加热可以促使其反应。这一反应也可用于无取代酰胺的合成。
2、羰基二咪唑:使用羰基二咪唑(CDI)与羧酸反应可得到活性较高的酰基咪唑,许多酰基咪唑有一定的稳定性,可以选择分离出来,但一般来说不用分离,反应液可直接与胺反应制备相应的酰胺。
3、磺酰氯:使用羧酸和磺酰氯生成羧酸-磺酸的混合酸酐,再与胺反应得到相应的酰胺。常用的磺酰氯有甲烷磺酰氯(MsCl)、对甲苯磺酰氯(TsCl)和对硝基苯磺酰氯(NsCl),对硝基苯磺酰氯由于其吸电子性,能与酸反应生成活性更高的混合酸酐,一般二级胺和三级胺,甚至位阻很大的胺都能顺利反应。
4、Boc酸酐:通过酸与Boc酸酐反应得到的混合酸酐与氨反应可得到相应的伯酰胺。
三、鎓盐类的缩合剂法
碳鎓盐类的缩合剂从盐的种类来分有以下两类:
1、碳鎓盐,目前常用的为HATU、HBTU、HCTU、TBTU、TSTU、TNTU等。
碳鎓盐试剂性能及应用的区别:HATU是活性最高的碳鎓盐类缩合剂,但由于价格昂贵,所以很少用于工业化生产,通常只在其它缩合剂效果不好时才用到它。HBTU相对来说要经济一些,虽然可以用于大多数缩合反应,但较低的收率使得其被限制用于大量生产。HCTU活性较高,可以代替HATU用于工业化生产,主要原因在于它有更好活性的Cl-HOBt中间体。TSTU和TNTU可以用于含水溶剂的酰胺化反应。
2、鏻鎓盐:PyBOP的是一个较为强的缩合剂,一般其他缩合剂缩合效果不佳时常常用PyBOP可以得到更好的结果。
四、有机磷类缩合剂
多种磷酸酯和磷酰胺类缩合剂也被广泛应用于酰胺的缩合。如二苯基磷酰氯(DPP-Cl)、氰代磷酸二乙酯(DECP)、叠氮化磷酸二苯酯(DPPA)、硫代二甲基磷酰基叠氮(MPTA)、二(2-氧-3-唑烷基)磷酰氯(BOP-Cl)。在这些磷酸酯和磷酰胺类缩合剂中,DECP常用于小量的多肽的合成,BOP-Cl特别适合与氨基酸的合成,其收率、消旋等都较好,但缺点是当胺的反应活性低时常得到酰化的唑烷。
五、酰卤法
酰卤(酰氯、酰溴和酰氟)与氨或胺作用是合成酰胺的最简便的方法。通过酰氯、酰溴与脂肪族、芳香族胺均可迅速酰化,以较高的产率生成酰胺。但酰氟对水和其他亲核试剂较为稳定。一般酰氯、酰溴与胺反应是放热的,有时甚至极为激烈,因此通常在冰冷却下进行反应,也可使用催化剂以减缓反应速度,常用的有二氯乙烷、乙醚、四氯化碳、甲苯等。由于反应会生成卤化氢,因此需要用碱除去卤化氢,以防止其与胺反应生成相应的盐。有机碱和无机碱均可用于此类反应,常用的有机碱有三乙胺、吡啶等,常用的无机碱有Na2CO3,NaHCO3, K2CO3,NaOH,KOH等。
酰氯主要通过二氯亚砜和三氯氧磷的制备。对于高沸点的底物来说,二氯亚砜是最合适的试剂,一般的酸在二氯亚砜回流数小时后,蒸掉过量二氯亚砜及溶剂后,再用些甲苯带一下残余的二氯亚砜即可用于下步反应。对低沸点的底物来说,则使用三氯氧磷较为方便,主要由于低沸点很容易蒸馏出来。
酰氟要比酰氯稳定,其对水和其他亲核试剂都较为稳定,其可通过三氟均三嗪在吡啶的存在下制备,并可以通过层析分离出来。酰氟对水和其他亲核试剂,易于保存和使用方便有时可以 利用它进行酰胺类化合物库的合成。
六、酰基叠氮法
酰基叠氮是一个较为温和的酰化试剂,由于在反应时其不会引起光学活性物质的消旋且对水及其他亲核试剂较为稳定,因而常用于肽及化合物库的合成,但酰基叠氮由于反应活性低,对于位阻大且亲核性低的胺是不适用的。
七、硫噻唑啉法
3-酰基-2-硫噻唑啉是一个较为温和的酰化试剂, 对各类胺的反应选择性较好,同时反应可以用乙醇作溶剂。该反应的一个特点是一般3-酰基-2-硫噻唑啉是黄色的,但反应完2-硫噻唑啉为无色,因此可以通过黄色是否消失来跟踪反应。
八、酯交换为酰胺
酯和氨水反应可以很方便地得到酰胺。N-取代酰胺一般可以利用相应的胺与酯直接反应得到,在有些条件下,需要有n-BuLi等强碱或AlMe3存在反应才能够顺利进行。
1、一般酯的氨解通过氨的醇溶液或氨水来进行:a. 氨的醇溶剂氨解反应可通过加入适量的甲醇钠和氰化钠来催化。b. 用氨水直接氨解一般需要加热(当该反应温度到100度时,一定要用高压釜做这一反应),这类反应一般可以通过硫酸铜来进行催化,反应的条件选择主要看酯的活性程度。
2、酯通过甲酰胺在乙醇钠的存在下,高温也可得到相应的酰胺。这一方法对各类的酯都比较有效,只是产品的分离比直接氨解稍微麻烦一些,但反应较快。
3、AlMe3-NH4Cl或Me2AlNH2在多官能团及复杂化合物的合成中用的较多,该方法条件较强,各类酯都能很快的氨解。其缺点是AlMe3易自燃,操作不是太方便。
九、氰基水解
腈加水可以分解为伯酰胺。由于伯酰胺会继续水解为羧酸,一般要控制水解的条件。有时需要根据底物的特性选择酸性,碱性或中性的水解条件。中性的条件有文献报道使用镍或钯催化剂的方法。
酸性水解:在酸性条件下与饱和碳相连的氰基,可以在酸中很方便的水解转化为酰胺,并在条件较为剧烈时,很容易进一步水解成酸。但乙烯基或芳基腈的水解条件则要求剧烈得多,一般需要强酸条件,而且一般不会进一步水解。
碱性水解:在碱性条件下,利用过氧化氢氧化的方法可在室温下短时间内水解腈为伯酰胺,这是一个较为可靠的方法。利用NaOH(aq.)-CH2Cl2相转移催化体系,DMSO-K2CO3体系可以用于各种腈水解为伯酰胺。
十、Ritter反应
叔碳正离子加成到腈基的氮原子上生成的腈盐加水分解得到相应的酰胺。一般能产生碳正离子化合物的都可以发生这类反应。由于醇或烯烃在浓硫酸或其他强酸加热条件下反应,一般在此条件下稳定的腈都可用于该类反应。这类反应通过腈和酸在溶剂中反应,但对于乙腈来说,直接在乙腈中反应即可,对于其他较为复杂,沸点较高的底物,一般用冰醋酸稀释。
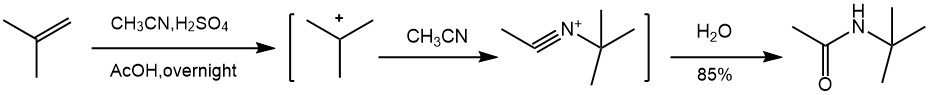
通过卤素或有机硒等对烯烃加成,得到的碳正性的中间体也可用于对乙腈的加成。如果所用的是环状烯烃,则为反式加成。Ritter反应是合成叔碳胺的一种重要方法。
如有侵权内容,请联系本公司工作人员删除文章。